Reacciones Químicas y Ecuaciones:
Introducción:
Gran parte de los procesos que tienen lugar en la vida cotidiana, tal como la oxidación del hierro en condiciones de libre exposición, la luminosidad que desprende una cinta de magnesio durante la combustión, la combustión del butano, la fabricación del jabón, etc., no son más que reacciones químicas, esto es, transformaciones de una sustancia en otra, con propiedades completamente diferentes. Ante ellas, los científicos se preguntan en qué consisten, cuáles son sus causas y consecuencias y cómo pueden modificarlos para adaptarlos a sus necesidades y obtener ventajas que mejoren nuestra vida.
Qué es Reacción química:
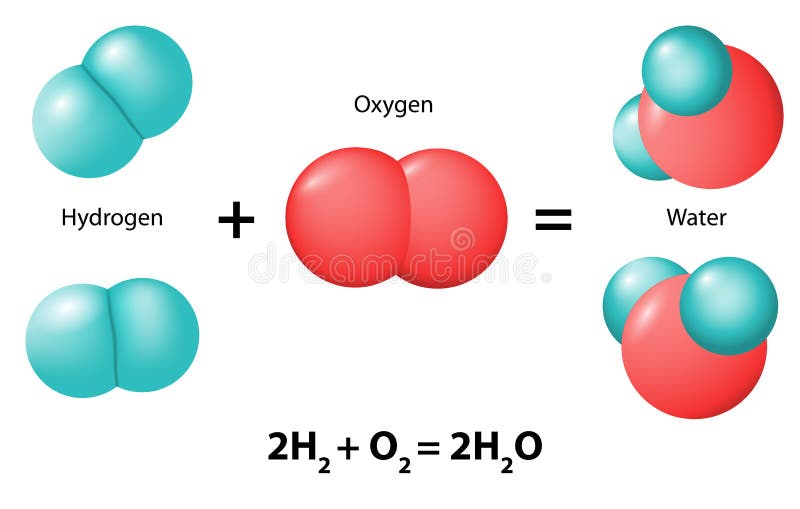
La reacción química es la forma en que una sustancia reacciona frente a otra. En una reacción química existen las sustancias que reaccionan, o sea las reactantes, y las sustancias producidas, llamadas productos.
Las reacciones químicas forman parte de las propiedades químicas e indican su comportamiento frente a otras mezclas y sustancias en la formación de nuevos productos.
En una reacción química se desencadena el proceso de ruptura de enlaces químicos creando espontáneamente, o por manipulación, una nueva ecuación o sustancia química. Por lo tanto, en una reacción química se deben juntar, mezclar o manipular las sustancias reactantes para la creación de productos químicos.
Dentro del área de la química orgánica que estudia las estructuras basadas en moléculas de carbono, en la fotosíntesis de las plantas, por ejemplo, existe una reacción química que transforma el dióxido de carbono absorbido por la clorofila de las hojas de las plantas en oxígeno.
Tipos de reacciones químicas:
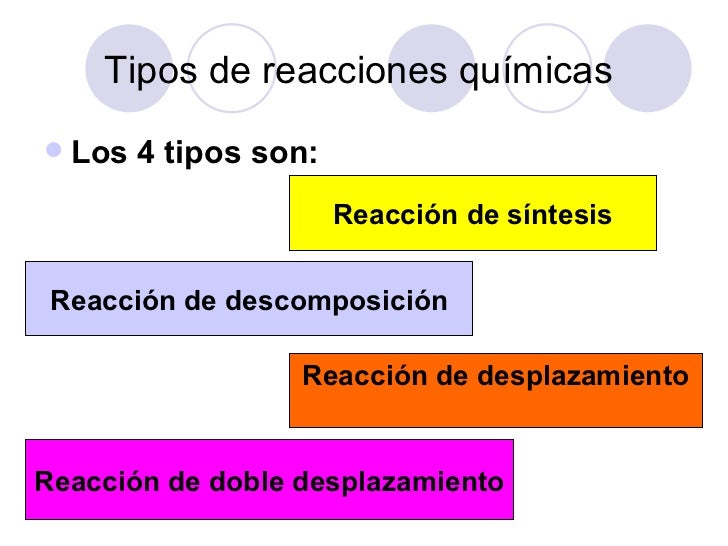
Existen en el campo de la química inorgánica cuatro tipos de reacciones químicas:
- Reacciones de síntesis o adición: los reactivos se juntan formando un producto (A + B = AB)
- Reacciones de análisis o descomposición: un reactivo forma varios productos (AB = A + B)
- Reacciones de desplazamiento: también llamada de sustitución simple, uno de los reactivos se desplaza hacia el más fuerte creando un producto (AB + C = A + BC)
- Reacciones de doble sustitución: los reactivos son sustancias compuestas, por lo tanto, cuando se mezclan se convierten en la mezcla no de dos sino de cuatro reactivos. La forma en que se asocian unas con las otras dependerá de sus propiedades químicas y de reacción. (AB + CD = AD + CB)
Es importante mencionar que las reacciones químicas modifican las propiedades químicas y no las físicas, por lo tanto, sus cambios en las estructuras pueden ser irreversibles, dependiendo de las propiedades de la sustancia en cuestión.
Concepto de ecuación química

Una reacción química es cualquier proceso en el que, por lo menos, los átomos, las moléculas o los iones de una sustancia se transforman en átomos, moléculas o iones de otra sustancia química distinta. Las reacciones químicas se escriben de forma simplificada mediante ecuaciones químicas.
En las reacciones químicas se cumple la ley de conservación de la masa, teniendo lugar una reordenación de los átomos, pero no su creación ni su destrucción. El reordenamiento de los átomos en la molécula da lugar a una sustancia distinta.
Las sustancias que se transforman o modifican en una reacción se llaman reaccionantes, reactivos o reactantes. Las sustancias nuevas que se originan en una reacción química se llaman productos.
Una de las reacciones químicas más usuales es la combustión del gas natural (mezcla de sustancias donde el metano, CH4, es el compuesto principal), cuya ecuación es:
La ecuación está «igualada», esto es, en cada miembro de la reacción hay el mismo número de átomos de cada elemento.
Ajuste de las ecuaciones químicas
Para ajustar una ecuación química hay que seguir el orden siguiente:
- Primero se ajustan los átomos de los metales, teniendo prioridad los más pesados.
- A continuación se ajustan los no metales, teniendo también prioridad los más pesados.
- Se revisa, si es necesario, el ajuste de los metales.
- Se comprueba el ajuste contando los átomos de hidrógeno y de oxígeno que intervienen.
Por ejemplo, para ajustar la reacción:
BaCl2 + Na2SO4 ® NaCl + BaSO4
siguiendo el orden indicado:
- Se empieza por el metal Ba, que es el más pesado. Como en ambos miembros hay un átomo de bario, no es necesario ajustarlo. Se sigue por el otro metal, el Na.Dado que en el miembro de la izquierda hay dos átomos de Na debemos poner un 2 delante del NaCl de la derecha, quedando:BaCl2 + Na2SO4 ® 2 NaCl + BaSO4
- Se siguen ajustando los no metales: cloro y azufre. Como ambos ya están ajustados y en ambos miembros existe igual número de átomos de oxígeno, se puede considerar que la reacción ya está completamente ajustada.
CONCLUSIONES:
Existen varios tipos de reacciones los cuales son: reacción de combinación, de descomposición, de sustitución y de doble sustitución, todos estos muy diferentes pero cumplen la misma función la formación de uno o varias sustancias y/o compuestos nuevos, los cuales pueden ser de mucha utilidad, o también pueden ser dañinos para la naturaleza.
WEBGRAFIA:
http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
http://www.hiru.eus/es/quimica/ecuaciones-quimicas-concepto-ajuste-y-tipos
https://es.slideshare.net/Garcia505/reacciones-quimicas-i
https://www.definicionabc.com/ciencia/reaccion-quimica.php
http://aprendeenlinea.udea.edu.co/lms/ocw/mod/page/view.php?id=246