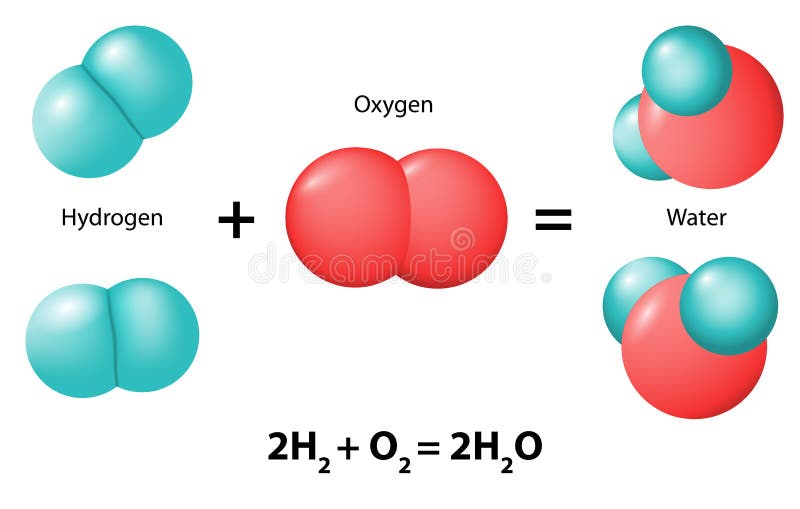
OXÍGENO Y HIDRÓGENO

- Introducción: En este trabajo se realizará un recorrido por diversos aspectos relacionados con los elementos químicos, oxígeno e hidrógeno. Acá se plasmará su estado natural, las propiedades físicas y químicas de cada uno, la combustión y partes de la candela, la obtención, reconocimiento y aplicación de el oxígeno e hidrógeno en los diferentes sectores. El oxígeno es un elemento químico gaseoso, no metal, de símbolo O, número atómico 8 y peso atómico 15.9994 y el hidrógeno Es un gas incoloro, inodoro, insípido, altamente inflamable y no es tóxico. De símbolo H, es un elemento gaseoso reactivo, incoloro e inodoro.
↣Objetivos:
- Definir el estado natural de cada elemento.
- Conocer las propiedades físicas y químicas de ellos.
- Explicar la combustión del oxígeno y las partes de la llama.
- Hablar sobre la obtención.
- Aprender sobre el reconocimiento de estos.
- Reconocer las diversas aplicaciones en la vida cotidiana.
↝Marco Teórico:
El Oxígeno: Es de gran importancia por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Es el elemento más abundante en la corteza terrestre. Cerca de una quinta parte (en volumen) del aire es oxígeno.
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
El oxígeno molecular (O2) representa el 20% de la atmósfera terrestre. Este oxígeno abastece las necesidades de todos los organismos terrestres y, cuando se disuelve en agua, cubre las necesidades de los organismos acuáticos. En el proceso de la respiración, el oxígeno actúa como receptor final para los electrones retirados de los átomos de carbono de los alimentos. El ciclo se completa en la fotosíntesis cuando se captura la energía de la luz para alejar los electrones respecto de los átomos de oxígeno de las moléculas de agua.
Por cada molécula de oxígeno utilizada en la respiración celular, se libera una molécula de dióxido de carbono. Inversamente, por cada molécula de dióxido de carbono absorbida en la fotosíntesis, se libera una molécula de oxígeno.

El Hidrógeno: El hidrógeno se quema en el aire formando una llama azul pálido casi invisible. Es el más ligero de los gases conocidos en función de su bajo peso específico con relación al aire. Por esta razón, su manipulación requiere de cuidados especiales para evitar accidentes. propenso a fugas debido a viscosidad y a su bajo peso molecular.
Propiedades y estado natural
Como la mayoría de los elementos gaseosos, el hidrógeno es diatómico (sus moléculas contienen dos átomos), pero a altas temperaturas se disocia en átomos libres. Sus puntos de ebullición y fusión son los más bajos de todas las sustancias, a excepción del helio. Su punto de fusión es de -259,2 °C y su punto de ebullición de 252,77 °C. A 0 °C y bajo una atmósfera de presión tiene una densidad de 0,089 g/l. Su masa atómica es 1,007. El hidrógeno líquido, obtenido por primera vez por el químico británico James Dewar, en 1898, es incoloro (excepto en capas gruesas, que tienen un aspecto azul pálido) y tiene una densidad relativa de 0,070. Si se deja evaporar rápidamente bajo poca presión se congela transformándose en un sólido incoloro.

ESTADO NATURAL
Oxígeno:En condiciones normales el oxígeno es un gas incoloro, inodoro e insípido; se condensa en un líquido azul claro. El oxígeno es parte de un pequeño grupo de gases ligeramente paramagnéticos, y es el más paramagnético de este grupo. El oxígeno líquido es también ligeramente paramagnético.
Hidrógeno:El hidrógeno en estado libre sólo se encuentra en muy pequeñas cantidades en la atmósfera, aunque en el espacio interestelar abunda en el Sol y otras estrellas, siendo de hecho el elemento más común en el Universo. En combinación con otros elementos, se encuentra ampliamente distribuido en la Tierra, en donde el compuesto más abundante e importante del hidrógeno es el agua, H2O. El hidrógeno se halla en todos los componentes de la materia viva y de muchos minerales. También es parte esencial de todos los hidrocarburos. Todos los ácidos contienen hidrógeno.
PROPIEDADES FÍSICAS Y QUÍMICAS
Oxígeno:
- Se
encuentra en estado gaseoso.
- Es
un gas incoloro, inodoro e insípido.
- El
oxígeno líquido tiene un color ligeramente azulado.
- El
oxígeno se presenta en tres formas alotrópicas: oxígeno normal, oxígeno
diatómico, oxígeno atómico y oxígeno triatómico (ozono).
- Este
elemento tiene tendencia a formar moléculas diatómicas (O2).
- La
propiedad química más importante del oxígeno es que soporta la combustión,
es decir, ayuda a otros materiales a quemarse. La combustión (quema) del
carbón vegetal es un ejemplo.
- Es poco soluble en
agua,
pero más soluble en agua que en nitrógeno.
- Es
un elemento reactivo.
- Se caracteriza
por ser un fuerte agente oxidante.
- Tiene
la facilidad de combinarse con otros elementos, especialmente para formar
óxidos.
- Posee elevada
electronegatividad.
- Es
el tercer elemento más abundante en el universo.
- Importante
en el proceso de fotosíntesis, en la respiración celular.
Hidrógeno:El hidrógeno es un gas in-oloro e incipido en temperatura ambiente se encuentra en estado gaseoso y pesa 14 veces menos que el aire, esta formado por dos atomos de H (H2) y están unidos por un enlace covalente, El hidrógeno es capas de combinarse con la mayoría de los elementos en las condiciones adecuadas tiene una gran afinidad con el oxigeno en una temperatura muy baja su mezcla se produce muy lenta mente mientras que en presencia de una chispa es casi inmediata generando una explosión. El hidrógeno también es un gas reductor a altas temperaturas reacciona con algunos gases reduciéndolos, se encuentra el Gas Hidrógeno que consiste en una molécula formada por dos átomos de Hidrógeno (H2). Éste se puede obtener a partir de la hidrólisis (Proceso por el cual se separan los átomos de Hidrógeno de los de Oxígeno en el agua).
-su numero atomico es 1
-su valencia es 1
-su estado de oxidación es +1
-su electro negatividad es 2y 1
-su radio covalente es 0,37
-su radio iónico es 2.08
-su masa atómica es 1,00797g/mol
-su densidad 0,071
-su punto de ebullición -252.7 °c
-su punto de fusión -259.2 °c
COMBUSTIÓN Y PARTES DE LA LLAMA
En la combustión una sustancia química reacciona rápidamente con oxígeno produciendo calor y luz. Los productos típicos de una reacción de combustión son CO2, H2O, N2 y óxidos de cualquier otro elemento presente en la muestra original.
Un ejemplo típico de combustión es la oxidación del metano según el proceso:
Las reacciones de combustión a menudo transcurren mediante la formación de radicales libres, moléculas o iones electrónicamente excitados que emiten fluorescencia dando color a la llama, o también formando pequeñas partículas de sólido (ejem. carbón) cuya incandescencia puede observarse.
La combustión es un proceso muy importante en nuestras vidas pues los combustibles se usan como fuente de energía, gasolina, gas, etc., en los medios de transportes, coches, aviones o en los hogares o industrias. Aunque hoy en día el proceso de la combustión esta bien entendido este proceso ha sido uno de los grandes enigmas desde los tiempos antiguos hasta finales del siglo XVIII en que Lavoisier (1743–-1794) consiguió dilucidar su naturaleza química.
Cuando se produce la combustión de un elemento inflamable en una atmósfera rica en oxígeno, se observa una emisión de luz, que puede llegar a ser intensa, denominada llama.
Todas las reacciones de combustión son muy exotérmicas y desprenden gran cantidad de energía en forma de calor. La llama es provocada por la emisión de energía de los átomos de algunas partículas que se encuentran en los gases de la combustión, al ser excitados por el intenso calor generado en este tipo de reacciones.

Partes:
En las llamas no luminosas se presentan tres zonas
claramente definidas como se observa en la figura:
Zona interna o interior fría, corresponde a los gases que no
entran en combustión, por lo que su temperatura es baja.
Zona intermedia o de reducción, es una mezcla intermedia en
la cual la combustión es incompleta y en la que se reducen los óxidos metálicos.
La zona de reducción está generalmente limitada a una mera envoltura del cono
interior.
Zona exterior o de oxidación, que es la parte más externa de
la llama y envuelve a las dos anteriores; por la abundancia de oxigeno hay
combustión completa y la temperatura es más alta. El punto más caliente de la
llama se encuentra en el interior de esta zona.

OBTENCIÓN
OXÍGENO:Puede obtenerse a partir de la descomposición térmica de óxidos (de metales poco reactivos, de los peróxidos, algunos bióxidos y algunas oxisales). Se puede obtener por electrólisis del agua. Por destilación fraccionada del aire liquido.

HIDRÓGENO:
El hidrógeno se obtiene mediante diversos procesos:
- electrólisis
- reformado
- gasificación
- ciclos termoquímicos
- producción biológica
Electrólisis:
La electrólisis es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.
Reformado:
El reformado, consiste en la reacción de los hidrocarburos con la presencia de calor y vapor de agua. Dicho método permite producir grandes cantidades de hidrógeno con un bajo coste, partiendo del gas natural.
Gasificación:
El hidrógeno a través del proceso de gasificación, se obtiene a partir de hidrocarburos pesados y la biomasa, obteniéndose además del hidrógeno, gases para reformado, a partir de las reacciones del vapor de agua y el oxígeno.
Ciclos termoquímicos:
Este proceso utiliza el calor de bajo coste producido de la alta temperatura que procede de la energía nuclear o también de la energía solar concentrada.
Producción biológica:
Las bacterias, y las algas, producen hidrógeno de manera natural y directa, cuando se encuentran en determinadas condiciones.
RECONOCIMIENTO
OXÍGENO:
Es posible obtener oxígeno al mezclar dióxido de manganeso con agua oxigenada; la reacción que se verifica es:
..... . .. .. .. .MnO2 (s)
2H2O2 (ac) --------------> O2 (g) + 2 H2O(l)
2H2O2 (ac) --------------> O2 (g) + 2 H2O(l)
El test característico para reconocer oxígeno es acercar al tubo donde se está produciendo el gas una pajuela encendida, con llama o sólo con una brasa. La llama se avivará al instante, o la brasa se encenderá. Se recomienda dejar un rato la reacción transcurrir antes de hacer el test, para permitir que el oxígeno producido desplace al aire que se encuentra en el tubo.
HIDRÓGENO:
La producción
de hidrógeno es un procedimiento muy simple y corresponde a una reacción
característica: se sumerge un trozo de zinc en una solución de ácido
clorhídrico no muy diluida. La reacción que se produce es:
Zn (s) +2 HCl
(ac) --> ZnCl2 (ac) + H2 (g)
(es posible
realizar la reacción análoga con magnesio, Mg)
El test
característico para reconocer hidrógeno corresponde a acercar al tubo donde se
está produciendo este gas un fósforo encendido; al tomar contacto con el
hidrógeno ocurre una explosión muy pequeña que apaga la llama del fósforo.
APLICACIÓN
OXÍGENO:
El oxígeno es vital para procesos tanto del mundo industrial como médico. El ozono, una sustancia compuesta por átomos de oxígeno, también se utiliza ampliamente en la industria.
Las plantas y animales dependen del oxígeno para respirar. Los humanos y animales inhalan oxígeno a los pulmones, o en el caso de los anfibios, a través de las branquias o la piel. El oxígeno le da energía a las células de la sangre antes de ser liberado como dióxido de carbono.
Suministrándolo como suplemento a pacientes con dificultades respiratorias,El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, facilitando el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno y se emplean botellas de oxígeno en diversas prácticas deportivas como el submarinismo o laborales, en el caso de acceder a lugares cerrados, o escasamente ventilados, con atmósferas contaminadas.
HIDRÓGENO: Elevadas
cantidades de hidrógeno son necesarias en industrias químicas y petrolíferas,
nominadamente en el proceso de “Haber” para la producción de amoníaco, el
quinto compuesto con mayor producción industrial.
Además de la
producción de amoníaco, el hidrógeno es también utilizado en la hidrogenación
de grasas y aceites, hidrosulfuración, hidrockaking, hidroalquilaciones, así
como en la producción de metanol entre otras.
El hidrógeno
está actualmente siendo testeado como fuente de energía “limpia” para la
utilización en transportes. La reacción del hidrógeno con el oxígeno, para
producir agua, realizada en células de combustibles es una de las formas más
promisorias para generar energía para automóviles, evitando la liberación de
gases de efecto invernadero, al contrario de lo que sucede con los motores
actuales que utilizan la combustión de hidrocarburos de origen fósil.
Otra enorme
promesa del hidrógeno a nivel de la energía es la fusión nuclear. Este proceso,
que alimenta la mayor parte de las estrellas que brillan en el firmamento,
produce helio a partir de núcleos de hidrógeno, liberando enormes cantidades de
energía.
Esta
reacción, que ya fue utilizada en su forma “descontrolada” en las bombas de
hidrógeno, se fuese llevada a cabo de una forma controlada, podrá permitir
tener una fuente de energía casi inagotable.
Otras
aplicaciones relevantes del hidrógeno son:
Producción de
ácido clorhídrico (HCl);
Combustible
para cohetes
Enfriamiento
de rotores en generadores eléctricos en puestos de energía, visto que el
hidrogeno posee una elevada conductividad térmica;
En estado
líquido es utilizado en investigaciones criogénicas, incluyendo estudios de
superconductividad.
↻Conclusiones:
- El oxígeno Es de gran importancia por ser el elemento esencial en los procesos de respiración de la mayor parte de las células vivas y en los procesos de combustión. Es el elemento más abundante en la corteza terrestre. Cerca de una quinta parte (en volumen) del aire es oxígeno.
- El Hidrógeno reacciona con una gran variedad de elementos no metálicos. Se combina con nitrógeno en presencia de un catalizador, formando amoníaco; con azufre formando sulfuro de hidrógeno; con cloro formando cloruro de hidrógeno y con oxígeno para formar agua. Para que se produzca la reacción entre oxígeno e hidrógeno a temperatura ambiente se necesita la presencia de un catalizador como el platino finamente dividido. Si se mezcla con aire u oxígeno y se prende, explota. También se combina con ciertos metales como sodio y litio, formando hidruros. Actúa como agente reductor de óxidos metálicos como el óxido de cobre, extrayendo el oxígeno y dejando el metal en estado puro.
⇗Web grafía:
- http://blogs.elespectador.com/actualidad/300-gotas/la-insuperable-mezcla-de-dos-atomos-de-hidrogeno-y-uno-de-oxigeno
- https://tintero.com.ar/index.php/site/article?slug=oxigeno-e-hidrogeno&category=enciclotin-lectura
- https://www.caracteristicass.de/oxigeno/
- https://prezi.com/8g5rydnbjwuv/propiedades-fisicas-y-quimicas-del-hidrogeno/
- https://www.investigacionyciencia.es/blogs/fisica-y-quimica/10/posts/la-combustin-y-el-oxigeno-10170
- https://es.wikipedia.org/wiki/Llama_(qu%C3%ADmica)
- https://www.ecured.cu/Llama_(combusti%C3%B3n)
- https://quimica.laguia2000.com/general/obtencion-del-hidrogeno
- http://ww2.educarchile.cl/portal.herramientas/sitios_educativos/planificador/activ/37.htm
- http://www.praxair.cl/gases/oxygen
- https://quimica.laguia2000.com/conceptos-basicos/aplicaciones-del-hidrogeno
- http://html.rincondelvago.com/oxigeno-e-hidrogeno_el-agua.html